遺伝子やゲノムに対する研究分野では、10年もすると考え方や概念が新しいものに入れ替わると言われています。
徳永勝士先生は東京大学で人類遺伝学の講義を担当されると同時に、遺伝情報やゲノム解析を通じて肝炎や結核などの発症メカニズムや治療方法に関する研究をされています。
徳永先生に遺伝子とゲノムとはどのようなものなのか伺うと同時に、医療をはじめとする各分野での活用例について教えていただきました。
遺伝子とは各種タンパク質の構造を決定する司令塔のようなもの
ヒトの体は、水分(50~70%)、タンパク質(15~20%)、脂質(13~20%)、ミネラル質(5~6%)、糖質(約1%)で構成されています。
遺伝子とは、ヒトの体の約20%を構成するタンパク質に対して、アミノ酸の並びを指定してタンパク質の構造を決定する機能を持ちます。タンパク質は脂質や糖質を体内で産生するときに必要な酵素のコントロールやミネラル代謝にも欠かせない存在のため、遺伝子は「人体を構造するうえで重要な司令塔のような存在」であるといえるでしょう。
遺伝子からタンパク質を産生する時「RNA」が欠かせない
遺伝子単体では、遺伝子が保有する情報を使ってタンパク質の合成をすることはできません。遺伝子が保有している情報を引き出すためのツールに、RNAと呼ばれる物質があります。RNAは働き方によって、mRNA(メッセンジャーRNA)、tRNA(トランスファーRNA)、mRNA(メッセンジャーRNA)とさらに細分化できます。
RNAが機能して、遺伝子から引き出した情報を細胞の構造や機能に変換する過程のことを遺伝子発現といいます。RNAによって遺伝子発現が生じた量のことを発現量と呼び、発現量はタンパク質の種類によって異なります。
ヒトをはじめ生物を構成する設計図となる情報を収めている遺伝子は、ゲノム情報全体に対して1.5%程度を占めていると考えられています。ここに遺伝子発現に関連する情報を加えると3%程度、遺伝子発現の調整に関する領域が加われば5%程度になると言われています。
残りの95%のうち、半分位以上がRNAに写し取られていることはわかっていますが、実際にそれらのRNAがどのような働きをしているのかについてはまだよくわかっていません。そのためRNAの解析は今後さらなる進展が待たれる分野でもあります。
そもそもゲノムとは?
ゲノムとは、生物がその生物であるために必要な基本設計のようなものです。例えばヒトのDNAは、ATGCと表記される4種の塩基(化合物のひとつ)が3×10の9乗(30億)並んで構成されています。ゲノムはこの4種の塩基がつながった横軸のような役割をしているモノ、というイメージが近いと言えるでしょう。
ゲノム(genome)の成り立ちは2種類ある
実は「ゲノム」という単語は、2つの成り立ちを持ち合わせていることをご存知でしょうか。
一つ目は、遺伝子(gene)と染色体(chromosome)からなる合成語で、各々の生物が必要とする染色体(遺伝子)セットという意味です。ゲノムの概念が出来上がるのに、日本の木原均先生が大きく貢献したのは1920年代、30年代です。
もう一つは、遺伝子(gene)と総体(-ome)から成る合成語として「遺伝子の総体」という意味で、どちらも基本的に同じ意味を持っています。
現在では、後者の考え方が普通になって、たとえば生物が産生するタンパク(protein)の総体はプロテオーム(proteome)と呼ばれるようになりました。私は学生への講義では、「ゲノム」という言葉の誕生に日本人研究者が貢献したことを知ってもらうため、第一の成り立ちも紹介しています。
遺伝子とゲノム解析は人類学や生物学でも活用されている

遺伝子やゲノムの解析や研究が世界にどのような影響を与えているのかについて、医療以外の分野では2つの例を取り上げることができます
進化遺伝学や集団遺伝学における研究
チンパンジーは遺伝学的にはヒトに一番近い生物といわれています。チンパンジーとヒトの祖先がいつ頃分岐して違う進化をたどるようになったのか研究する際、ゲノム解析によって得られたデータは、現在のところ最も正確かつ有力な資料であるとされています。
このことは集団遺伝学で行われている民族の形成や起源に関する研究においても、同様です。例えば日本人のルートをたどると複数の先祖集団に行き着くことがこれまでの研究でわかっていますが、この調査研究でも遺伝子やゲノム解析によって得られたデータが活用されています。
生物資源や食料資源の改善・保全でも活用されている
産業面でもゲノム解析技術の導入が進んでいます。たとえば、寒さなどに強い遺伝子を組み込んだ農作物の開発や、より多くの生乳を採れる乳牛の改良などに使用されることで、食料の供給安定化が可能になりつつあります。
また一方で、生物の保全を目的とした研究でもこの技術は活用されています。かつて日本で見かけるタンポポやメダカは日本固有種でしたが、近年では外来種との交配が進んだことにより急速に個体数が減少しました。外来種の国内流入状況や生態系のかく乱について調査するときにも、このゲノム情報が活用されているのです。
遺伝子とゲノム解析が医療に与える影響とは?

個人のゲノム情報を解析して、特定の病気の診断や治療、予防に活用する医療のことを「ゲノム医療」と呼びます。
遺伝子やゲノム研究と医療とのつながりを考えるとき、「遺伝病」と「多因子病」が重要なキーワードになります。
「遺伝病」と「多因子病」の違い
多くの病気は、「遺伝病」と「多因子病」に大別できることをご存知でしょうか。
遺伝病とは、単一遺伝子の異常を保有している方が高確率で発症する病気の総称で、ハンチントン病や血友病などが具体例として知られています。遺伝病は特定の遺伝子の働きを損なう稀な突然変異を保有していることで発症するため、人口に対する発症率は低く、希少疾患や難病に指定されていることがほとんどです。
一方で多因子病とは、遺伝的な特徴に加えて生活習慣、環境など複数の要因が積み重なって生じる病気の総称で、生活習慣病として有名な2型糖尿病や高血圧、関節リウマチ、がんなど悪性腫瘍などが該当します。
多因子病では、個々の遺伝要因は発症リスクに多少影響を与えているものの、遺伝要因だけで発症が決まるのではないという捉え方をしています。つまり、「特定の遺伝子型を保有しているため発症リスクは多少上昇するものの、生活習慣を含む環境要因のコントロールができれば予防可能」という考え方です。これは多因子病の特徴といえるでしょう。
遺伝病と多因子病では治療や予防に対するアプローチが異なる
遺伝病に関する研究は現在さかんに行われており、発症メカニズム解明に向けて多くの機関が研究を続けています。各機関の努力もあり、現在では希少疾患・難病指定されている疾患全体の3割程度で、原因遺伝子の突然変異に関する知見が得られています。
現在の医学では治療や予防の確立が難しい遺伝病についても、原因遺伝子変異を特定することによって、発症メカニズムの解明や新しい治療法の開発につなげようとしています。
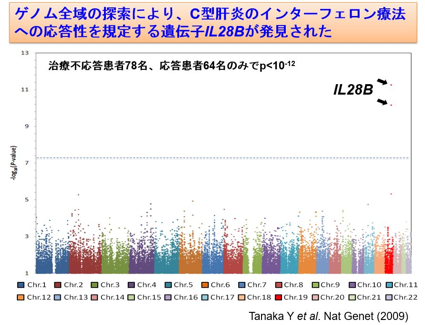
一方で多因子病の発症と予防に関するアプローチは、遺伝病のそれとは全く異なります。ここでは2型糖尿病を例に考えてみましょう。2型糖尿病との関連が考えられている遺伝子型は現在100種類程度が特定されています。しかしこれは、推定される遺伝要因全体の1~2割程度にすぎません。もっと多くの遺伝子型を見つける研究が、国内外の大規模な共同研究によって進められています。そして研究過程で、新しい治療薬開発のヒントが得られている例もあります。
またゲノム解析が進み、2型糖尿病発症に関連する遺伝子がほぼ特定されれば、病気のなりやすさを個人で把握した上で生活習慣に気をつける「個人主体の予防」が一般的になるのではないかと考えています。
民間企業が実施する遺伝子検査ビジネスでは検査内容が限定されている

遺伝病に関する遺伝子検査は医療に該当する
遺伝子検査とは、血液や唾液などの検体からDNAを採集して遺伝子やゲノム情報を読み取る検査です。
遺伝病に関する遺伝子検査は医療に該当するという考えから、厚生労働省は遺伝病に関する遺伝子検査は医療機関で行えるものと限定し、民間企業が個人に対し遺伝病を対象にした遺伝子検査を扱えないようにしました。こうした経緯から、現在民間で行われている遺伝子検査の対象は多因子病や、いわゆる体質に限定されています。
遺伝子情報の多くは解析途中
すでにお伝えしましたが、遺伝子やRNAの大半はまだ解析途中です。先に例としてご紹介した2型糖尿病発症との関連が考えられる遺伝子も、まだ全体の1~2割程度しか解析されておらず、大部分が今も謎に包まれている状態です。
現在世界中で遺伝子やゲノムの解析や研究が進められているため、2型糖尿病に関連している遺伝子が1,000個、2,000個と判明していけば、発症予測精度も向上していくだろうと考えています。
しかし現在行われている遺伝子検査ビジネスに対して、遺伝子やゲノムを扱う専門家としては、正確な発症予測などを求めるというよりも利用者がある種の知的好奇心を満たすものという認識を持っています。
ゲノム医学研究のこれから

日本国内で実施されているゲノム医学研究は、希少疾患・難病、がん、糖尿病、感染症、認知症、精神疾患などについて大規模な研究が行われています。現在私は感染症その他の多因子疾患についてのゲノム研究を担当しています。
最近では肝炎ウイルス(病原体)のゲノムと、ヒト(宿主)のゲノムの両方の情報を調べていますが、両者のゲノムの特徴から肝臓がんへの進行のしやすさについてある程度予測できるようなデータが取れつつあります。今後さらに研究が進めば、肝炎から肝臓がんへの進行リスクについて、さらに精度の高い検査が可能になると考えています。
ゲノム解析が進めば、医療の可能性はさらに大きく広がります。たとえば、病気の原因となる遺伝子の異常など病気の原因変異が判明すれば、ある病気を疑ったときに遺伝子検査を実施することによって診断を確定できるようになったり、ゲノム情報に基づいて治療薬の選択や処方量の調整が可能になるのではと考えています。
また、ゲノム解析が進んで数万人あるいは数十万人単位のゲノムデータ蓄積が進めば、これまで無関係と考えられていた複数の病気にゲノム上の因果関係を見いだせるかもしれません。
医師の方へ
様々な学会と連携し、日々の診療・研究に役立つ医師向けウェビナーを定期配信しています。
情報アップデートの場としてぜひご視聴ください。

