
ミトコンドリア病のなかでも最も患者数の多いMELAS(メラス)は、脳卒中様発作を主な症状とし、発症から数年で死に至ってしまう難しい病気と考えられてきました。久留米大学病院小児科教授の古賀靖敏先生は、変異遺伝子を持つ方のMELAS発症予防や、発作時の症状緩和のために研究を重ねられ、L-アルギニン塩酸塩を用いた世界初のMELAS治療薬の開発を目指しておられます。日常生活のなかから除去すべきMELASのリスク因子や、治療開発の現状について、古賀先生にお話しいただきました。
MELASの遺伝形式-母系遺伝とは?
MELASは「母系遺伝」という遺伝形式をとり、母から子へと遺伝することがあります。ただし、後述するように子孫が必ずMELASを発症するわけではありません。
なぜA3243G変異は母親から遺伝するのか?
MELASの主な原因であるA3243G変異は、母親から子孫へと母系遺伝もしくは細胞質遺伝し、父親から伝わることはありません。これは、父親由来の変異ミトコンドリアDNAが、精子の尾部に集積するためです。ミトコンドリアのATP合成によりエネルギーが作られることで、精子の尾部は繊毛運動をすることができます。その後、卵子と結合して受精卵が形成されるときには、精子の核のみが残り、ミトコンドリアDNAの存在する尾部は切り離されます。一方、卵子にはミトコンドリアが存在するため、変異自体は子どもすべてに伝わります。これが、MELASの原因遺伝子変異が父親からは遺伝しない理由です。

A3243G変異を持っていても健康に生活している人は多い
仮にA3243G変異を持っていたとしても、変異率が低ければMELASをはじめとする病気の症状が現れることはありません。実際にA3243G変異を持っている患者さんご家族の多くは、無症状で健康に生活されています。
また、オーストラリアのクイーンズランド州で行われたポピュレーションスタディでは、人口10万人あたり16.3人がA3243G変異を持っていることがわかっています。
ヘテロプラスミーとはどのような概念か
MELASにかぎらず、A3243G変異を原因とするミトコンドリア病では「ヘテロプラスミー」の割合を考えることが重要です。一つの細胞内には何百ものミトコンドリアが存在し、その一つ一つのミトコンドリア内に5~10個のミトコンドリアDNAが存在しています。
一つの細胞の中に、正常なミトコンドリアDNAと変異ミトコンドリアDNAが共存している状態を、ヘテロプラスミーと呼びます。
MELASなど、ミトコンドリアDNAの変異に起因するミトコンドリア病は、ヘテロプラスミーの割合(変異と正常の比率)、すなわち変異率がある値を超えることで発症すると考えられています。
世界でこれまでに行われた研究では、MELASを発症した患者さんのうち、最も低いA3243Gの変異率は、尿の検体を用いた検査で35%であったと報告されており、この数値以下であればA3243G変異を持っていてもMELASを発症する可能性は低いといえます。
これとは逆に、A3243Gの変異率が高くなると、MELASではなくLeigh脳症というより重い病型となることもあります。
MELASの出生前診断は現時点では不可能
変異率のほかに、A3243G変異の臓器分布も、病気の発症に関与する重要な要素です。仮に脳に多く分配されたとしたらLeigh脳症など重い病型となる可能性が高まり、心臓に多く分配されたとしたら心筋症を合併する可能性が生じます。しかし、A3243G変異に関しては、どの臓器にどう分配されるのか、法則が全くわからないため、保因者の方が妊娠された場合でもMELASの出生前診断を行なうことはできません。
MELASのリスク因子
上述した通り、母親となる方がA3243G変異を持っている場合、子どもにも必ず変異は遺伝します。そのため私は患者さんのご家族のなかに、これから妊娠や出産を考えている女性(保因者)がいる場合、必ずMELASとその治療法、予防法についてご説明することをポリシーとしています。
また、患者さんのご家族のなかに変異率が比較的高く、今後MELASを発症する可能性を考えられる方がいる場合には、日常生活から除去すべきリスク因子についてもお話ししています。
MELASの発症に関与するリスク因子には、以下のようなものが挙げられます。
- 寒冷曝露
- 脱水
- 過剰なストレス
- 発熱
- 低アルギニン血症
たとえば、過剰なストレスを避けるため、進学時や就職時など、人生の節目には無理をしないことが大切です。また、低アルギニン血症もリスク因子となるため、次項でご解説するL-アルギニン塩酸塩を忘れずに内服することも重要です。
参照:Molecular pathology of MELAS and L-arginine effects. https://www.ncbi.nlm.nih.gov/pubmed/21944974
なぜMELASの治療薬としてL-アルギニン塩酸塩を用いるのか?
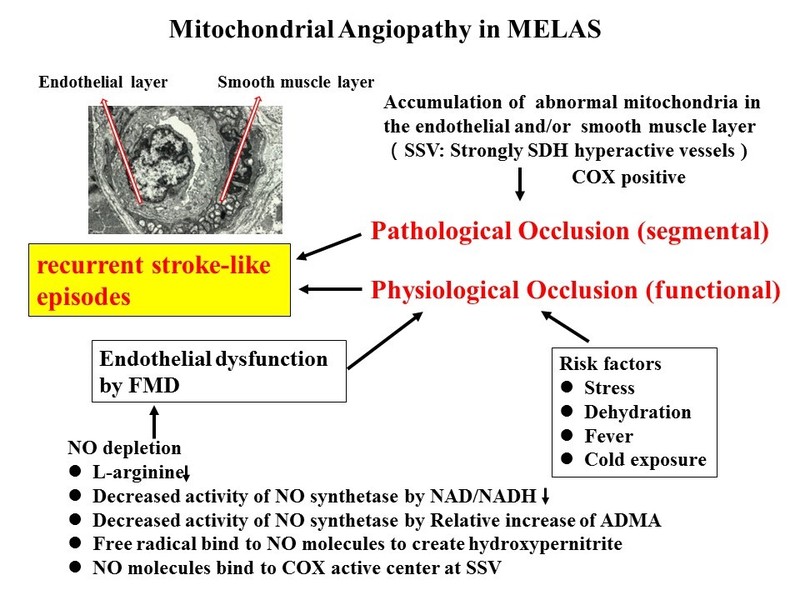
MELASでは、血管病理学的に血管のセグメンタルな狭窄部位が存在することが、患者さんの脳の病理検査によりわかっています。このような病理学的狭窄がある患者さんに、アルギニンの低下や精神的ストレス、寒冷暴露、脱水などの悪化因子が加わると、脳動脈が容易に攣縮し、脳梗塞のような発作が起こると考えています。L-アルギニン療法とは、L-アルギニン塩酸塩を用いて、脳の血管が攣縮しないように広げていく治療です。
L-アルギニン塩酸塩の内服がMELASの発症予防や片頭痛の軽減につながる可能性
既にMELASを発症している患者さんに対しては、久留米大学病院でL-アルギニン療法を実施しています。実際にL-アルギニン塩酸塩を内服している患者さんのなかには、発作が起こる間隔が長くなった方や、発作を起こした場合でも麻痺がほぼ遺らず、リハビリテーションの必要もないほど軽度で済んだという方もおられます。
保因者の方のリスク因子除去、MELAS発症予防のために
このほか、A3243G変異を持っており片頭痛に悩まれている保因者の方に対しても、MELAS発症予防のためにL-アルギニン塩酸塩を処方しており、有症時には内服していただいています。
L-アルギニン塩酸塩の内服を続けていただき、生涯MELASを発症することなく健康に過ごしていただきたいと切に願っています。
MELASにより脳卒中様発作を起こした直後のL-アルギニン塩酸塩の静脈注射
脳の異常部位の消失を確認

MELASの患者さんのなかには、初回の脳卒中様発作を起こしてから6年で重症認知症(血管性認知症)に至ってしまわれた方もいます。また、このような特に重い例でなくとも、脳卒中様発作を起こした後の脳画像所見をみていくと、障害された異常部位は治ることなく日ごとに広がっていくことがわかっています。そのため、これまでは脳卒中様発作後、多くの患者さんに何らかの後遺症が遺っていました。
この問題を克服するため、私たちは脳卒中様発作後3時間以内(急性期)にL-アルギニン塩酸塩の静脈注射を行い、その後42日間にわたり脳画像所見を観察しました。この結果、発作後12時間では異常部位がみられるものの、7日後と42日後には脳の障害部位が完全に消失することが明らかになりました。
特に、脳卒中様発作後になるべく早期(2時間以内)にL-アルギニン塩酸塩を使用すれば、全く神経学的後遺症もなく、MRIでの異常画像も1週間で消失するという現象を経験しております。(Kitamura M, et al. J Neurology (2016) 263:1666-1668. )
したがって、脳卒中様発作後はできるだけ早期にL-アルギニン塩酸塩で治療する必要があります。
MELASと診断されている患者さんへ-脳卒中様発作後すぐに受診を!
夜間休日問わず即座にL-アルギニン塩酸塩の静脈注射を行える体制づくり
久留米大学病院ではこの結果を受け、既にMELASと診断のついている患者さんが脳卒中様発作を起こして搬送されてきたときには、夜間休日問わず、救急外来ですぐにL-アルギニン塩酸塩の静脈注射を行える体制を整えています。
当院では研修医も含めて、救急外来を受け持つ医師が即座に治療できるよう教育も徹底していますので、周辺地域にお住まいの患者さんご家族には、症状が出たらすぐに来て欲しいとお伝えしたいです。
また、全国の施設でL-アルギニン塩酸塩の静脈注射と内服を行えるよう、引き続き治療薬の承認申請のための準備を進めていく所存です。
ミトコンドリア病の患者さんを救うために
命を守るための卵子核移植に関する国民的議論を
MELASと遺伝に関する項目で、A3243G変異は母から子へと母系遺伝すること、また、出生前診断はできないということをお伝えしました。そのため、現在の日本では、ミトコンドリア病の素因を持っている方が妊娠・出産を考えておられるときには、お子さんが病気を発症した場合の説明やリスク因子の除去などについてご説明することしかできません。お子さんのミトコンドリア病発症を防ぐ手段として唯一ご紹介できるのは、イギリスで実施されている卵子核移植です。卵子核移植とは、卵子から保因者である母親の核を抜き、健康なドナー女性の核を移植する治療法です。
日本には卵子核移植を行なうに足る十分な技術はあるものの、国民間の議論が成熟しておらず、卵子核移植が認められるにはまだまだ時間がかかるといわざるを得ません。
しかし、ミトコンドリア病患者さんの保護者の会に所属されている方々からは、日本でも卵子核移植を行えるよう議論を進めて欲しいと、切なる声が多数寄せられています。
卵子核移植には倫理的観点などから多くの反対意見もありますが、私は日本ミトコンドリア学会理事長として、「ミトコンドリア病からお子さんの命を守る」という目的の卵子核移植であれば、ひとつの選択肢として提示できる時代が来てほしいと考えています。また、目的を異にする卵子核移植については、しっかりと切り離して考えていかなければなりません。
ミトコンドリア病患者さんの救済のために、今後日本全体で卵子核移植に関する議論がなされ、一定の方向性が示されていくことを期待しています。
久留米大学医学部小児科学教室・教授
まずはメディカルノートよりお客様にご連絡します。現時点での診断・治療状況についてヒアリングし、ご希望の医師/病院の受診が可能かご回答いたします。
- 受診予約の代行は含まれません。
- 希望される医師の受診及び記事どおりの治療を保証するものではありません。
医師の方へ
様々な学会と連携し、日々の診療・研究に役立つ医師向けウェビナーを定期配信しています。
情報アップデートの場としてぜひご視聴ください。
関連の医療相談が2件あります
だんなさんはミトコンドリア病
だんなさんはミトコンドリア病で子供は遺伝しますか?13歳の男の子と8歳の女の子、今は健康です。彼らは遺伝子検査を受ける必要がありますか?
側頭葉てんかんもち、頚椎神経根神経症もち、です。なやんでいます
頚椎神経根症はっしょうしてから、睡眠に、入る時や、入ってから、体があっちこっちと。びくつきます。 一分間にひどい時は20回。その日は、1時間しか、睡眠が取れなかったのですが、最近は、びくつきの時、前よりびくつきが、小さいために、熟睡していないように、感じますか、このままほっておいて大丈夫なのか、心配です。また、側頭葉てんかん医師に相談したところ、てんかんからではないと言われました。
※医療相談は、月額432円(消費税込)で提供しております。有料会員登録で月に何度でも相談可能です。
「受診について相談する」とは?
まずはメディカルノートよりお客様にご連絡します。
現時点での診断・治療状況についてヒアリングし、ご希望の医師/病院の受診が可能かご回答いたします。
- お客様がご相談される疾患について、クリニック/診療所など他の医療機関をすでに受診されていることを前提とします。
- 受診の際には原則、紹介状をご用意ください。



